- 内置蛋白质传感器可实现活细胞内分子组装的无创追踪
- 来源:作者:斯蒂芬・丹杰洛(康奈尔大学)) 发表于 2025/7/7
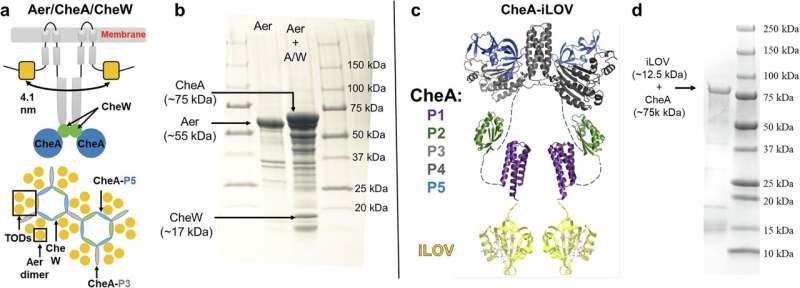
通过电子自旋共振技术分析的两种不同化学传感系统:具有内源性黄素中心的 Aer 蛋白,以及由小型黄素蛋白 iLOV 提供外源性黄素中心的 CheA 蛋白。图片来源:《自然・通讯》(2025)。DOI:10.1038/s41467-025-60623-6
康奈尔大学的研究人员发现了一种新方法,有望更精准地观察活细胞内蛋白质的动态 —— 利用细胞自身成分作为内置传感器。
这种方法可帮助科学家研究分子在细胞内(包括病毒内部)的结合方式,以及蛋白质在癌症、神经退行性疾病等病症中发生错误折叠的机制。
研究团队发现了一种创新手段:利用细胞自身产生的天然蛋白质作为微型传感器,用以报告其所处环境及相互作用,避免了传统侵入性技术可能对细胞正常生物学过程的干扰及对研究结果的扭曲。该研究成果发表于《自然・通讯》期刊。
“这种方法主要用于理解新的生物学机制,例如与癌症等疾病状态或感染过程相关的机制,” 布莱恩・克兰(Brian Crane)表示。他是文理学院化学与化学生物学系的乔治・W・与格蕾丝・L・托德讲席教授,也是该论文的通讯作者。
“例如,我们可以设想用这种方法追踪病毒的组装过程,从而了解其组分在细胞内的构建方式与位置。”
克兰作为威尔细胞与分子生物学研究所的负责人,与同事们聚焦于黄素(flavins)—— 这类源自维生素 B2 的小分子在细胞内可充当磁性标签。其磁性特性使其能通过电子自旋共振(ESR)光谱技术检测,该技术类似核磁共振成像(MRI),但可测量纳米级距离及极小的变化。通过追踪携带黄素的黄素蛋白(flavoproteins)的行为,研究人员能够监测其他分子在活细胞内的组织与运动模式。
由于黄素蛋白广泛存在于多种生物系统中,研究团队找到了将其作为内置传感器的方法。通过光激发黄素的磁性特性,他们可借助 ESR 技术直接在细胞内研究蛋白质结构,无需依赖合成化学物质。
“我们在研究某些黄素蛋白的特性时发现,它们的磁自旋态在细胞内的稳定性超出预期,” 蒂莫泰・肖维雷(Timothée Chauviré)说。他是威尔研究所克兰实验室的研究助理,也是该研究的第一作者,“从先前对光敏蛋白的研究中,我们意识到可以利用光来激发信号,从而通过 ESR 技术检测这些分子。”
克兰指出,强行向细胞内导入人工标签可能干扰细胞功能,而细胞会自然产生含黄素的探针,“如果能诱导细胞自身合成这些探针,效果会好得多。”
为验证这一新方法,研究人员以细菌蛋白 Aer 为研究对象,该蛋白协助大肠杆菌感知氧气。Aer 与另外两种蛋白 CheA、CheW 协同作用,实现跨膜信号传导。尽管这些蛋白此前已被研究,但这是科研人员首次直接观察到 Aer 受体在活细胞内的组装过程。
“我们发现,Aer 会形成高阶组装体 —— 膜内的分子阵列,通过协同作用放大信号,” 克兰表示,“这些结构稳定性差,在细胞外无法形成。”
借助 ESR 技术,团队以埃(Å)级精度测量了 Aer 二聚体(由两个相同蛋白分子组成的复合物)中两个黄素间的距离,不仅证实了二聚体结构,还揭示了细胞内形成的更大组装体。
研究人员还开发了一种名为 iLOV 的小型工程黄素蛋白,可通过基因融合技术与其他蛋白结合,使其能被 ESR 技术可视化。这种工具如同分子标签,使科学家能够研究活细胞内几乎任何蛋白质的结构与定位。
该研究还证实,此前主要局限于试管内纯化蛋白研究的 ESR 技术,如今可用于活细胞系统,且能呈现惊人的细节。
“电子自旋共振光谱技术不再局限于研究纯化分子或重组系统,” 克兰说。
他透露,团队目前正将该方法应用于其他细胞类型,尤其是哺乳动物细胞,探索能否在更复杂的环境中追踪相关生物学过程。
更多信息:蒂莫泰・肖维雷等,《黄素蛋白作为活细胞电子自旋共振光谱的天然及基因编码自旋探针》,《自然・通讯》(2025)。DOI:10.1038/s41467-025-60623-6
期刊信息:《自然・通讯》
康奈尔大学提供
- 如果本文收录的图片文字侵犯了您的权益,请及时与我们联系,我们将在24内核实删除,谢谢!















